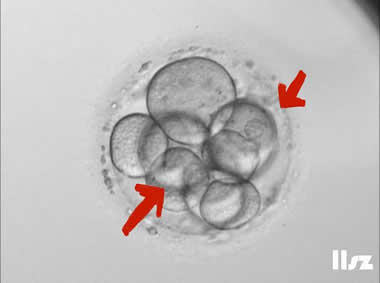
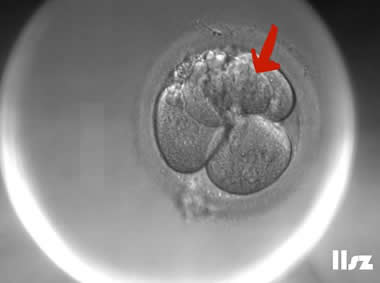
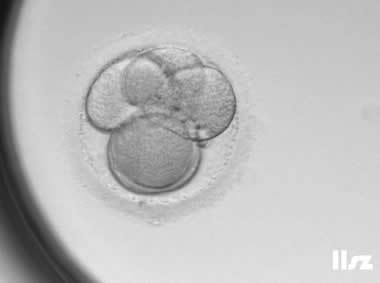
4人类配子和胚胎图鉴
4.1 前言
欢迎来到《人类配子和胚胎图鉴》的世界,一本详尽揭示生命最初秘密的宝典。这不仅是一份视觉的盛宴,更是一项科学的里程碑,将深邃的胚胎学知识转化为易于理解的视觉表现。我们的图鉴涵盖了一个奇迹的旅程和篇章:精子的微观力量、卵母细胞的纯洁优雅、合子的神奇融合、卵裂期胚胎的快速生长以及囊胚阶段的构造之美。每一幅图都是一次对生命起源的密切观察,其背后是形态学评估方法的科学支持。
胚胎形态学评估在辅助生殖中至关重要,通过观察外观预测发育潜力和妊娠可能。然而,胚胎发育复杂,多种形态异常需精准识别,这对胚胎学家是挑战。为此,我们推出《人类配子和胚胎图鉴》,全面记录正常与异常形态,既是新手学习资源,也是资深胚胎学家的参考工具。此书深化了我们对生命早期的理解,提升了胚胎评估准确性,有助于提高妊娠成功率,体现对生命的尊重。
与传统的书籍相比,本平台发布的《人类配子和胚胎图鉴》有三个主要的优势:首先,它融入了视频元素,让读者能够动态地观察胚胎在不同阶段的变化,这比静态图片提供了更丰富的信息和更直观的理解。其次,我们采用网络传播方式,这意味着不仅可以包含视频等多媒体内容,而且可以持续更新,确保知识的时效性和准确性。最后,我们秉持合作共赢的精神,热烈欢迎同行提供原创素材,只要我们收录您提供的五个以上的作品,您即可成为本书的作者之一。这种开放的合作模式不仅丰富了内容,也促进了学术交流和知识共享。
《人类配子和胚胎图鉴》力求全面、准确地呈现胚胎学知识,但仍可能存在局限性。由于作者知识水平限制及胚胎发育的复杂性和个体差异,部分描述可能不够精确或全面。同时,随着科技的发展和领域共识的更新,部分内容可能无法完全反映当前前沿技术或理论。后续我们将持续更新内容,确保科学性和时效性。此外,图鉴可能尚未覆盖所有胚胎形态或异常情况,未来会进一步补充完善。欢迎读者和同行提出宝贵意见,帮助我们优化内容,力求提供更全面、准确的胚胎学知识资源。
本书的每一幅,每一帧图都不仅仅是一幅/帧单纯的图形,而是孕育生命的动态过程的珍贵篇章。它提醒我们,每个生命的开始都充满了奇迹和可能,而科学的严谨与精细绘图,犹如显微镜下的诗篇,让每一个生命旅程更加触手可及。让我们一同翻开这本图鉴,感受生命之谜的壮丽吧。
孙雷
2025年1月20日
4.2 版权说明
版权归属
《人类配子和胚胎图鉴》版权持有者为所有参编人员,受中华人民共和国著作权法保护。未经许可,任何个人或实体不得以任何形式复制、发行、改编、公开传播或以其他方式使用本书中的内容,包括但不限于电子版、印刷版或任何形式的数字化版本。
除非获得明确书面许可,不得在商业用途中使用本书内容,也禁止用于任何形式的营利活动。如果需引用本书中的信息或图片,请务必事先书面申请,并在使用时注明原著及作者信息。
任何企图侵犯本书版权的行为,将被视为违法行为,并可能导致法律追责。感谢您对知识产权的尊重和理解。
分享和使用说明
教学和研究用途:您可以出于教育和研究目的在课堂、论文或研究项目中引用图鉴中的内容。请确保提及原版本的来源,并遵循引文规范。
个人学习:作为个人学习资料,您可以在个人学习或学术讨论中使用,但不得用于公开分享,且不得以盈利为目的。
网络传播:本书内容不得在任何形式的网络平台上(包括社交媒体、博客、网站或论坛)未经授权地公开发布或传播。如需在线分享,请确保链接指向本书的正式出版途径。
商业用途:如有商业用途,如出版、展览、产品设计,需要获得版权所有者的书面许可,并支付相应版权费用。
修改和转制:未经许可,不得擅自修改或以任何形式改写本书内容,包括但不限于图解制作、翻译。
请尊重每一副图,每一个视频背后的研究与科学,以确保这些宝贵的知识被公平且准确地使用。如果遇到任何版权相关问题,欢迎随时联系我们(sunshijie12345@163.com或微信公众号后台)。
创作团队
主编:吴洪波,孙雷
副主编:期待您的加入……(仅限五位)
编者名单(按拼音字母顺序):邓薇薇,胡天,黄晶晶,黄丽萍,黄忠诚,梁荣伟,潘逼然,叶夏,期待您的加入……
4.4 卵子图鉴
4.4.1 卵冠丘复合物的评估
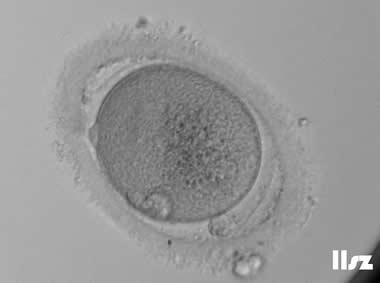
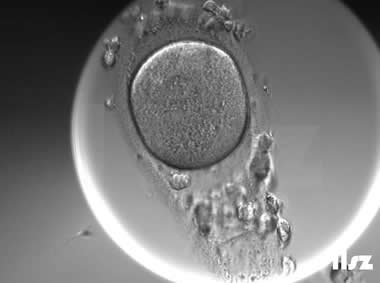
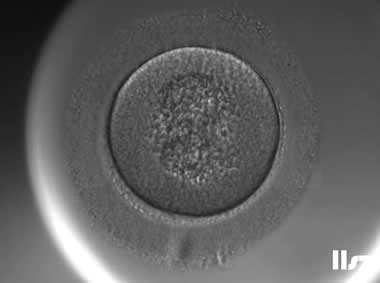
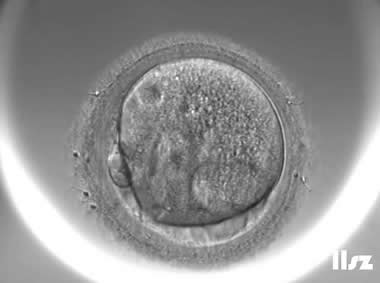
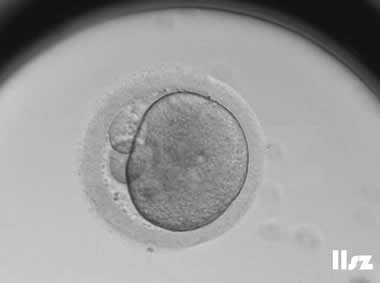
在辅助生殖技术(ART)中,卵冠丘复合物(ooctye-cumulus complex, COCs)的形态学分析可用于评估卵母细胞的质量和发育潜力。COCs由卵母细胞及其周围的卵丘细胞、放射冠及透明带外基质共同构成,其形态特征(如卵丘细胞层的致密性、扩散性、黏液样结构等)与卵母细胞的成熟度密切相关。通过显微镜下观察COCs的形态,可推测出卵母细胞是否处于核成熟(MII期)阶段。成熟的COCs通常表现为卵丘细胞层松散扩展、呈放射状排列,而紧密包裹的卵丘细胞则提示卵母细胞可能尚未成熟。
COCs的评估对临床具有重要的指导意义:首先,通过对COCs评估,可以了解卵母细胞胞质成熟与核成熟的情况,从而预测其受精率;其次,COCs的完整性还与胚胎质量直接相关,高质量的COCs更可能形成囊胚发育潜能强、染色体异常率低的优质胚胎,从而提高临床妊娠率和活产率;此外,对于形态学评估中发现的未成熟卵母细胞(如GV期或MI期),可通过体外成熟培养(IVM技术)进一步诱导其成熟,为卵巢低反应或排卵障碍患者提供额外的可利用卵源,扩大治疗机会。
COCs根据卵子的成熟度可以分为五个阶段或级别:(1)GV期卵母细胞;(2)不成熟卵母细胞(MI);(3)成熟卵母细胞(4)过成熟卵母细胞;(5)退化或闭锁卵母细胞。另外,还存在部分其它异常卵母细胞的情况。各个时期的图形特征如下:
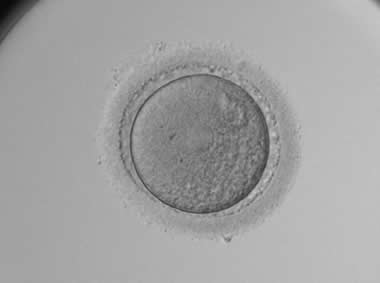
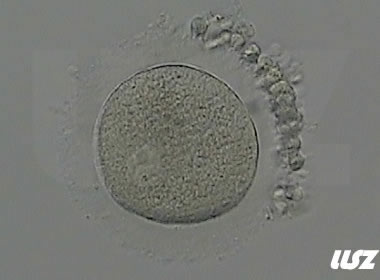
1. GV期卵母细胞及其COCs
在此阶段,卵细胞中央颜色稍深,或呈颗粒状,放射冠未发生分散,颗粒细胞排列紧密,且呈深色或颗粒细胞团较小,卵母细胞中央有时可见GV泡。GV期卵母细胞处于第一次减数分裂前期,一般需在体外培养24小时后才能核成熟,胞质成熟时间需更久。
 | 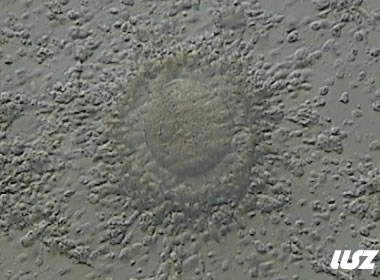 |
| 0小时COCs的GV卵(4x) | 0小时COCs的GV卵(10x) |
 |  |
| 2小时COCs的GV卵(10x) | 4小时去颗粒细胞后的GV卵(10x) |
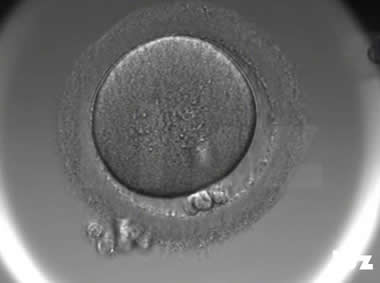
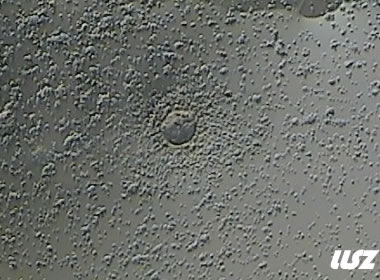
2. 不成熟卵母细胞(MI)及其COCs
卵细胞颜色变浅,放射冠开始分散,颗粒细胞排列逐渐稀疏,颜色亦变浅,不可见GV和第一极体。不成熟卵母细胞的核成熟时间可以发生在体外培养15个小时以内。
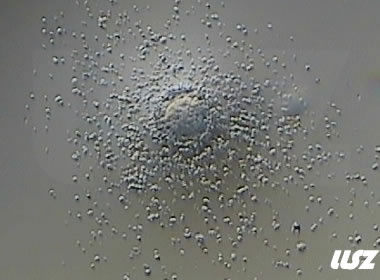 |  |
| 0小时COCs的MI卵(4x) | 0小时COCs的MI卵(10x) |
 |  |
| 2小时COCs的MI卵(10x) | 4小时去颗粒细胞后的MI卵(10x) |
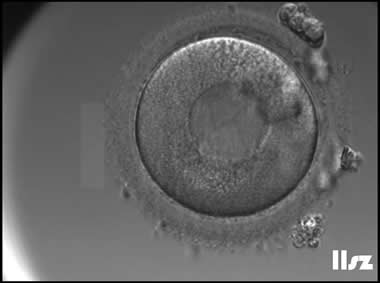
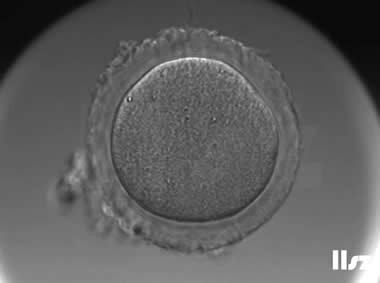
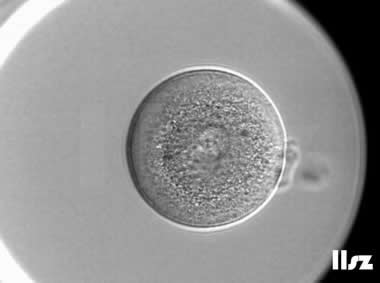
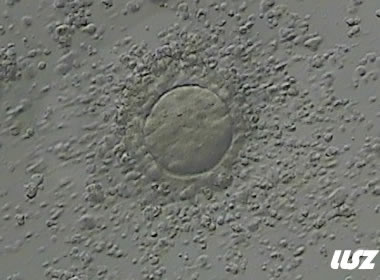
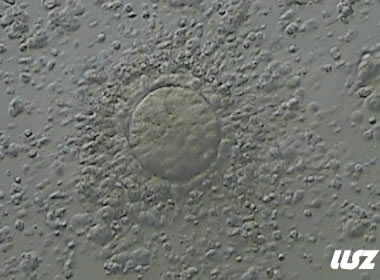
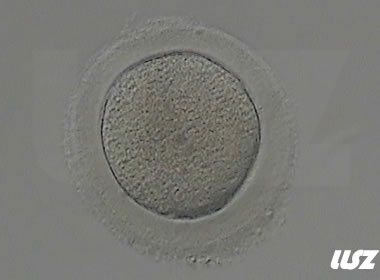
3. 成熟卵母细胞(MII)及其COCs(正常COCs)
卵细胞呈现规则的圆形且颜色较浅,放射冠完全分散,颗粒细胞团较大,排列稀疏。成熟卵母细胞一般在取卵后体外培养2-6小时再行授精。
 | 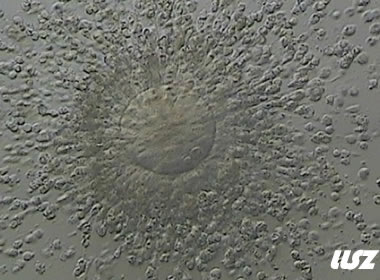 |
| 0小时COCs的MII卵(4x) | 0小时COCs的MII卵(10x) |
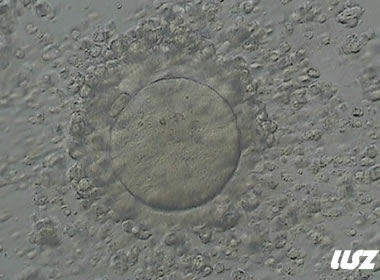 |  |
| 2小时COCs的MII卵(10x) | 4小时去颗粒细胞后的MII卵(10x) |
4. 过成熟卵母细胞及其卵冠丘复合物(待更新)
5. 退化或闭锁卵母细胞及其卵冠丘复合物(待更新)
4. 异常卵母细胞及其COCs
该案例中,卵母细胞黄素化,透明带破裂,用酶消化颗粒细胞后仅剩一团变形的胞质。
 | 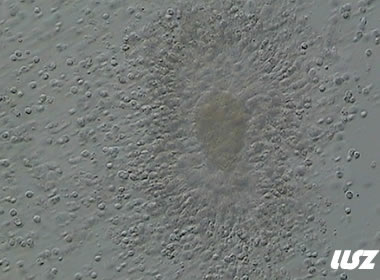 |
| 0小时COCs的异常卵(4x) | 0小时COCs的异常卵(10x) |
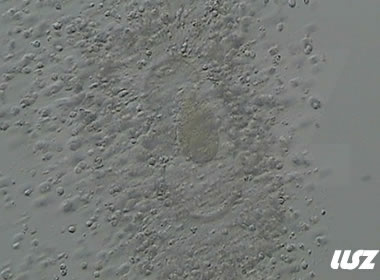 | 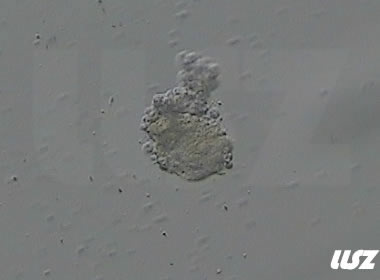 |
| 2小时COCs的异常卵(10x) | 4小时去颗粒细胞后的异常卵(10x) |
4.4.2 卵母细胞的成熟度判断
通过对卵冠丘复合物形态学分析以推测卵子的成熟度,可以反映卵子的IVF受精率,胚胎质量,以及临床妊娠率。然而,受激素的影响,某些卵冠丘复合物形态差异较大,同时,颗粒细胞的包裹也增加了判断的难度。对于准备进行ICSI(单精子注射)的卵子去除颗粒细胞后,可以直观地观察到卵子的结构。
对拆除颗粒细胞后的卵母细胞进行成熟度评估具有重要意义,它能够直观的观察卵母细胞的关键结构(如第一极体、细胞质形态等),准确判断其成熟阶段(GV期、MI期、MII期、过熟或退化),从而优化受精策略选择(如ICSI或IVF)、提升胚胎发育潜力、降低非整倍体风险,并为个体化治疗提供依据。此外,这一评估是ICSI操作和冷冻保存的必要前提,是辅助生殖技术中的关键环节。
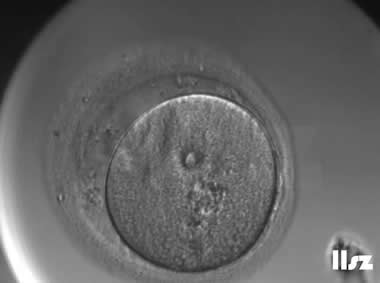
1. GV卵母细胞
细胞核未破裂,核膜完整,可见较大的生发泡;处于第一次减数分裂前期,染色体未排列到赤道板;线粒体分布不均,胞质内脂滴较多,皮质颗粒未完全迁移至质膜下。
无法自发完成减数分裂,不能直接受精;若体外培养至成熟(IVM),成功率低,胚胎染色体异常风险高;通常需体外成熟培养,但发育潜能较低。
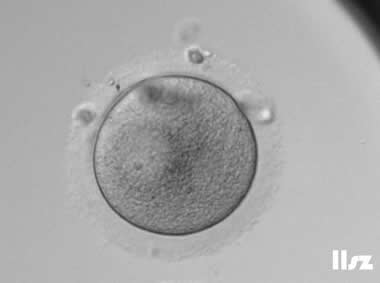 | |
| GV卵母细胞:该枚卵子从GV卵发育为MI卵,然后从MI卵发育为MII卵。 | |
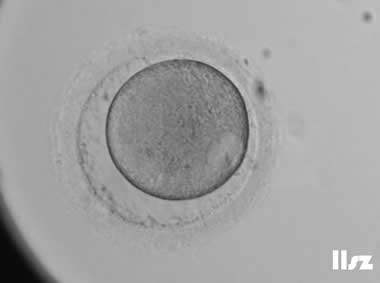 | |
| GV卵母细胞:该枚GV卵经过培养后发育为MI卵母细胞,发育过程中反复出现突起,最后在没有受精的情况下分裂为2细胞。 | |
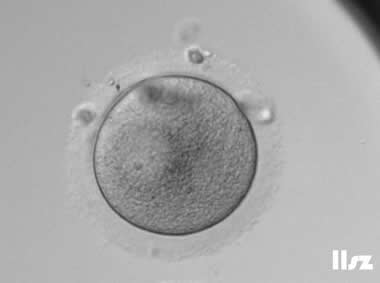 | |
| GV卵母细胞:该枚GV卵母细胞直接发生了退化。 | |
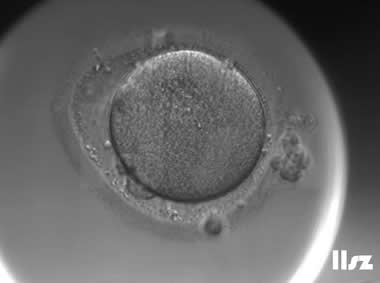
2. MI卵母细胞
MI卵母细胞的生发泡消失,减数分裂恢复,进入第一次减数分裂中期,但未排出第一极体;染色体可能未完全对齐,纺锤体结构不稳定;线粒体开始向胞质外周迁移,但皮质颗粒分布不均。
MI卵母细胞约20-30%可能受精,但易出现异常受精(如多精受精);形成的胚胎易停滞在卵裂期,囊胚形成率低;部分MI卵母细胞可体外继续成熟至MII期,但质量次于自然成熟的MII卵母细胞。
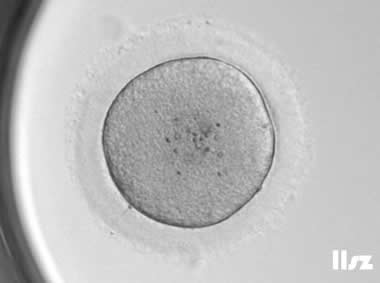 | |
| MI卵:该枚卵子从MI卵发育为MII卵,在未行授精的情况的下逐渐退化。 | |
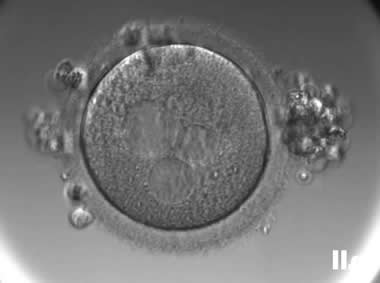
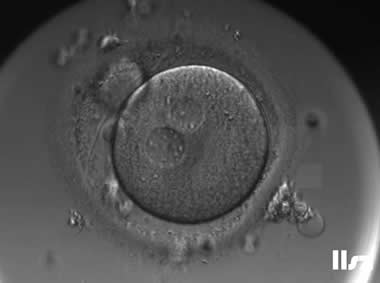
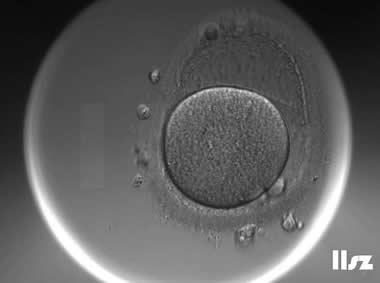
3. MII卵母细胞(成熟卵母细胞)
MII卵母细胞完成了第一次减数分裂,排出第一极体,处于第二次减数分裂中期;染色体整齐排列在赤道板,纺锤体对称且紧贴质膜;线粒体均匀分布,皮质颗粒完全迁移至质膜下,胞质内脂滴减少。
MII卵母细胞可正常受精,是辅助生殖技术(如IVF、ICSI)的首选阶段;染色体非整倍体率低,囊胚形成率高(约40-60%),临床妊娠率显著提升;黄金标准阶段,可直接用于受精。
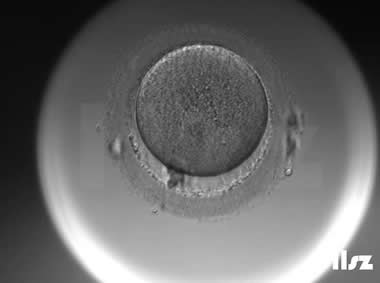 | |
| MII卵:该枚卵子为正常且成熟的MII卵母细胞,正常受精并形成了囊胚。 | |
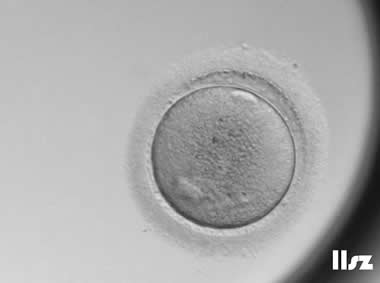 | |
| MII卵:该枚卵子为MII卵母细胞,受精后出现了大量空泡,随后逐渐退化。 | |
4. 过成熟卵母细胞
过成熟卵母细胞的第一极体碎裂或膨胀,纺锤体结构紊乱或消失;染色体排列松散,可能出现提前分离或非整倍体;胞质颗粒化,线粒体功能下降,活性氧(ROS)积累。
过成熟卵母细胞约30-40%可能受精,但易出现受精失败或异常受精;胚胎碎片增多,易停滞在4-8细胞期,流产风险升高;需谨慎使用,胚胎非整倍体率显著增加。
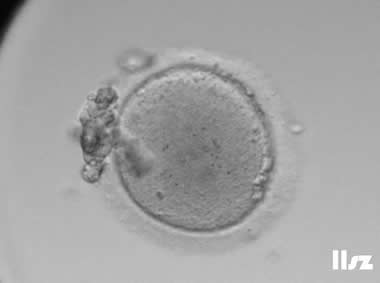 | |
| 过成熟卵母细胞:该枚卵子极体碎裂,胞质颜色偏深,脱颗粒细胞后逐渐退化。 | |
5. 退化或闭锁卵母细胞
退化或闭锁卵母的胞质空泡化碎片化,细胞膜破损;生发泡碎裂或溶解,染色体分散或溶解;线粒体肿胀,内质网扩张,皮质颗粒消失。
退化或闭锁卵母完全丧失受精能力;即使人工激活,也无法发育为胚胎;直接废弃,不可用于辅助生殖。
4.4.3 MII卵母细胞的异常形态
对于MII卵子,还需进一步评估卵母细胞的形态是否存在异常。卵母细胞的形态评估主要针对卵母细胞的纺锤体、透明带、极体、透明带下间隙、卵细胞折光性及其内容物等进行观察。正常成熟的卵母细胞应当具有完整、对称的纺锤体;光滑且厚度均匀的透明带;形态完整的第一极体;透明带下间隙适中且无碎屑;胞浆折光性均匀且清亮。这些特征共同反映了卵母细胞的健康状态及其潜在的发育能力。
MII卵母细胞的异常形态主要可分为三类,分别是卵母细胞的大小形状异常,胞质内异常(胞质颗粒化,空泡和滑面内质网等)和胞质外异常(极体,卵周隙和透明带等),MII卵母细胞的异常图鉴如下:
ps:为了观察MII卵子的整体而连续发育情况,我们的视频都是来自已经受精的MII卵子,因此,视频中可能部分IVF授精方式的卵子已经受精并排出了第二极体。
1. 卵母细胞的大小和形状异常
(1)大小异常的卵母细胞
人类卵母细胞的直径为100μm-150μm,外层包围着15~20μm厚的透明带。如果卵母细胞过小,可能由于其在卵泡内发育过程中营养不足或生长受限,导致细胞内含物的缺失,进而影响其正常发育。相反,对于直径明显比较大的卵母细胞,通常被称为“巨卵”(一般比正常卵子大30%以上),这些卵母细胞通常为2倍体或多倍体。在部分未成熟的巨卵中,可能会观察到两个或更多的极体或GV。成熟的巨卵在受精后,常常会出现三个原核(3PN)或更多的原核。部分卵子可发育至囊胚阶段,但大部分为多倍体,因此,不建议使用。
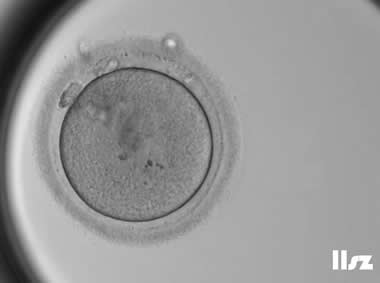 | |
| 巨卵:该枚卵子为巨卵,受精卵出现了3PN(可能卵子为2倍体),卵裂中出现了多次不均等分裂或直接分裂等异常分裂情况,最终该卵子未能发育成囊胚。 | |
(2)形状异常的卵母细胞
在健康的卵母细胞中,细胞形态通常表现为规则的圆形。轻微的形态变异对卵母细胞的发育影响较小,但当形态变异显著时,例如椭圆度过高或出现严重变形,可能会对卵母细胞的受精能力及后续胚胎发育潜力产生不利影响。
| |
形状异常卵子:该枚卵子受透明带的影响轻微变形,正常受精并形成了囊胚。 | |
| |
形状异常卵子:该枚卵子透明带严重畸形,卵子受透明带的影响轻微变形,最后发育为不规则形状的囊胚。 | |
| |
形状异常卵子:该枚卵子形状异常,受精卵出现了多个小的原核,在分裂一次后停止了发育。 | |
2. 卵母细胞的胞质异常
(1)胞质颗粒化
在显微镜下,正常的卵母细胞胞浆通常呈现均匀致密的细颗粒状结构,是核成熟阶段的典型特征,并且,颗粒化程度与卵子的成熟状态和质量密切相关。当卵母细胞的胞浆颗粒化程度较为严重或呈现过分清亮的现象时,通常提示卵母细胞存在异常。这种异常常常与卵母细胞的内在结构问题、成熟度不足或细胞内环境不稳定相关,这些因素都会直接影响卵子的受精能力和后续的胚胎发育。因此,卵母细胞若表现出明显的颗粒化或过度清亮,通常伴随较低的受精率和较差的胚胎质量。
| |
| 胞质中央区域颗粒化:该枚卵子中央颗粒化,正常受精,但出现了直接卵裂和不均等卵裂等情况。 | |
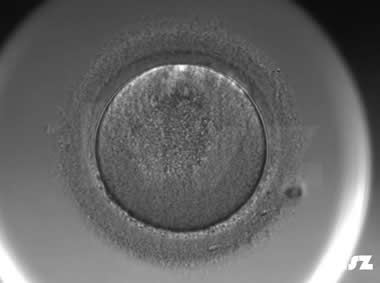 | |
| 胞质中央区域颗粒化:该枚卵子中央颗粒化,正常受精和卵裂。 | |
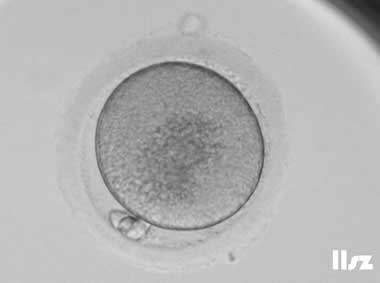 | |
| 胞质中央区域颗粒化:该枚卵子中央颗粒化,正常受精并形成了囊胚。 | |
(2)空泡
卵母细胞内的空泡是卵子形态异常非常常见。空泡由膜包裹和内部液体构成,空泡的形成可以是自发出现,也可能由高尔基体或滑面内质网的融合所导致。空泡的存在可能会导致卵母细胞内部纺锤体位置的异常,从而干扰细胞骨架的正常结构,这会影响卵母细胞的分裂和成熟过程。研究显示,含有空泡的卵母细胞常常显示出较低的受精率和着床率,并且流产的风险增加,特别是当空泡直径超过14μm时,其对卵子的影响尤为显著,受精率显著降低。
| |
| 胞质多空泡:该枚卵子胞质有多空泡,受精正常,部分细胞有异常卵裂的情况,后期虽形成囊胚,但囊胚质量不高。 | |
(3)滑面内质网
滑面内质网(Smooth Endoplasmic Reticulum,SER)是细胞内的一种重要细胞器,负责脂质合成、钙离子储存和解毒等功能。卵母细胞中的滑面内质网具有特殊的结构特点,它不仅参与细胞内的基本代谢过程,还在卵母细胞的成熟过程中发挥关键作用。研究显示,滑面内质网的存在会导致胚胎质量变差,妊娠率降低等。
| |
| 滑面内质网:该枚卵子存在一个大的滑面内质网,卵裂异常并出现了较多碎片,后期未能形成囊胚。 | |
| |
| 滑面内质网:该枚卵子存在多个滑面内质网,卵裂中出现了较多碎片,但后期形成了囊胚。 | |
3. 卵子胞质外异常
(1)第一极体(PBI)
PBI的存在对评估卵母细胞的成熟程度具有重要意义。一般来说,存在第一极体的卵母细胞通常处于第二次减数分裂的中期阶段(通常为核成熟的标准),然而,有时会发现第一极体并未完全脱离胞质,两者间仍有连接,这表明此时可能处于第一次减数分裂末期,因此这样的卵母细胞并不具备充分的受精和发育潜力,此时进行IVF/ICSI,往往具有较低的受精率和卵裂率,所以应该孵育至完全成熟再行授精。另外,PBI的形态评估还可用于判断排卵后卵子的成熟度,近期研究显示,极体异常如多个极体或碎极体,可能存在减数分裂错误。但是,随着PBI在体外时间的增加,也会发生退变,因此,PBI的异常并不能完全用于预测受精率和妊娠率等情况。
| |
碎极体:该枚卵子为碎极体,正常受精并形成了囊胚。 | |
| |
碎极体:该枚卵子为碎极体,正常受精,虽然出现了部分碎片,但卵裂正常。 | |
| |
| 大极体:该枚卵子为大极体,正常受精,卵裂异常,后期形成了囊胚但质量不高。 | |
| |
| 大极体:该枚卵子为大极体,正常受精,第一次卵裂为不均等卵裂,未能形成囊胚。 | |
| |
多极体:该枚卵子为多极体,正常受精,但是卵裂异常,最终细胞碎片化。 | |
(2)卵周间隙(PVS)
PVS异常包括大小异常和有无内容物。正常卵母细胞的透明带下间隙内通常没有其他内容物。透明带下间隙内粗大颗粒的存在可能是卵母细胞退化的迹象,表明卵母细胞的质量较差,可能显著影响胚胎质量和发育潜力。透明带下间隙的宽度是评估卵母细胞成熟度的重要指标之一,如果透明带下间隙过窄,往往意味着卵母细胞的成熟度较差;透明带下间隙过宽,虽然已有多篇文献报道其可能对胚胎质量产生影响,但结果并不一致,表明过宽的间隙与胚胎质量之间的关系尚不明确。
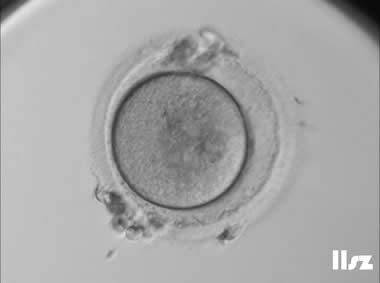 | |
| PVS大且含少量颗粒物:该枚卵子PVS大,正常受精并形成了囊胚。 | |
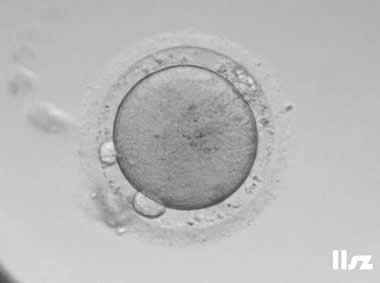 | |
| PVS大且含少量颗粒物:该枚卵子PVS大且含少量颗粒物,正常受精,但在第一次卵裂时就发生了异常。 | |
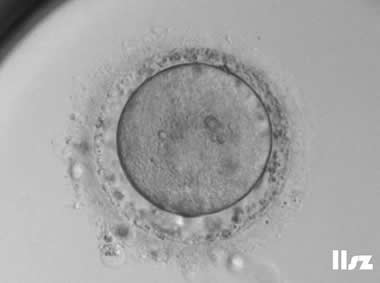 | |
| PVS大且含较多颗粒物:该枚卵子PVS大且含较多颗粒物,正常受精,并且卵裂正常。 | |
(3)透明带(ZP)
ZP异常包括ZP畸形和蜡样透明带等,呈现多层,暗色,毛状,过薄或过厚。多项研究表明,透明带变深的卵母细胞在受精、胚胎发育以及着床率方面与正常透明带的卵母细胞没有显著差异。透明带形态异常对胚胎发育的影响差异较大,一般而言,椭圆形或梨形的透明带对胚胎发育影响较小,然而,如果透明带形态如果过度拉长,可能会影响胚胎的正常发育及囊胚形成。在透明带缺失的卵母细胞中,会严重影响胚胎的发育以及囊胚的形成。
| |
| 透明带过薄:该枚卵子透明带过薄且含少量颗粒物,正常受精,卵裂过程中出现了连续卵裂模式。 | |
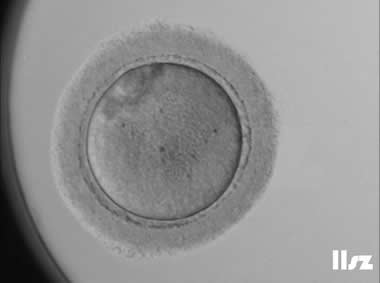 | |
透明带过厚:该枚卵子透明带过厚,正常受精并形成了囊胚。 | |
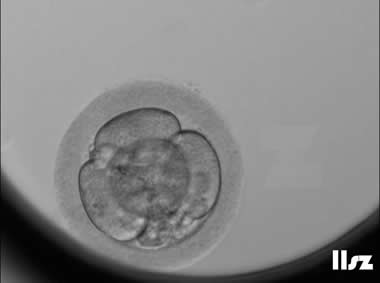 | |
透明带过厚:该枚卵子透明带过厚,正常受精,卵裂过程中出现了较多碎片,后续形成了囊胚(受聚焦影响,囊胚不清晰)。 | |
| |
| 蜡样透明带:该枚卵子为蜡样透明带,ICSI受精,卵裂异常,并逐渐碎片化。 | |
| |
| 透明带畸形:该枚卵子透明带有一半偏薄,卵子正常受精但含有少量空泡,第一次卵裂为不均等卵裂,最后形成了囊胚。 | |
| |
| 透明带畸形:该枚卵子透明带并不是常规的圆形,稍微有些变形,该枚卵子正常受精并形成了囊胚。 | |
| |
| 透明带畸形:该枚卵子透明带畸形,透明带中间有一层膜状结构将透明带内部分成了两个区域,该枚卵子正常受精并形成了囊胚。 | |
| |
| 无透明带卵子:该枚卵子无透明带,正常受精,可发生分裂,但没有透明带包裹容易导致各细胞分离,需培养至囊胚才能使用。 | |
| |
| 无透明带卵子:该枚卵子无透明带,正常受精且正常分裂,发育过程中所有细胞都粘附在一起,最终发育成了囊胚(该案例由黄石市中心医院生殖中心罗冰冰提供)。 | |
4.6 卵裂胚图鉴
4.6.1 卵裂胚的形态学评估
卵裂期胚胎评估在辅助生殖技术中至关重要,旨在筛选出具备最佳发育潜能、能够成功着床并分娩健康活婴的胚胎。通过科学的评估方法,可以显著提升胚胎移植的成功率,降低早期流产的风险,并减少选择发育异常胚胎的可能性。
卵裂期胚胎的形态学评估关键指标包括卵裂球数目、均一性、碎片数量与分布、胚胎色泽与胞质形态,以及透明带和卵周隙状态等。目前,卵裂期胚胎评分我们建议参考:"人类卵裂期胚胎及囊胚形态学评价中国专家共识." 中华生殖与避孕杂志 42.12(2022):8.
卵裂胚胚胎(第3天)评级专家共识
| 评级 | 细胞数 | 均匀度 | 碎片 | 多核 |
| Ⅰ级 | 8-细胞 | 均匀 | <10% | 无 |
| Ⅱa级 | 8-细胞 | 均匀 | 10%~25% | 无 |
| ≥8-细胞 | 大部分细胞相对均匀 | <10% | 无 | |
| 6~7-细胞 | 具备阶段特异性卵裂模式 | <10% | 无 | |
| Ⅱb级 | ≥8-细胞 | 大部分细胞相对均匀 | 10%~25% | 无 |
| 6~7-细胞 | 具备阶段特异性卵裂模式 | 10%~25% | 无 | |
| Ⅲa级 | 4~5-细胞 | 具备阶段特异性卵裂模式 | <25% | 无 |
| Ⅲb级 | ≥4-细胞 | 细胞间大小差异较大或不具备阶段特异性卵裂模式 | <25% | / |
| ≥4-细胞 | / | 26%~50% | / | |
| Ⅳ级 | <4-细胞 | / | / | / |
| / | / | >50% | / |
下面视频是胚胎在时差培养箱中培养至D3的整个过程,图片是D3(第68小时)的卵裂期胚胎图,本文D3胚胎评价是以D3时间点图片的形态学为依据,胚胎评级如下:
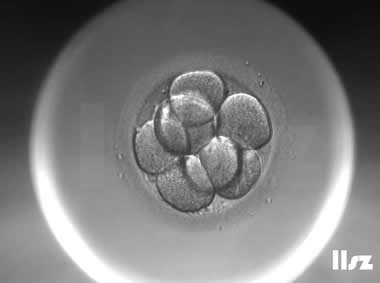 | |
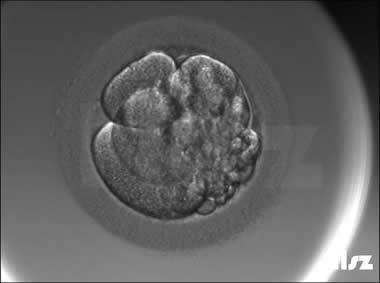
| Ⅰ级:该枚D3胚胎为8细胞,碎片不超过10%,因此评级为I级。 | |
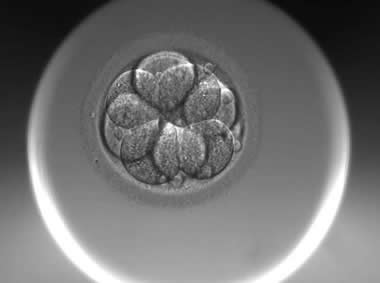 | |
| Ⅱa级:该枚D3胚胎为8细胞,碎片在10%左右,因此评级为I级或Ⅱa级均可。 | |
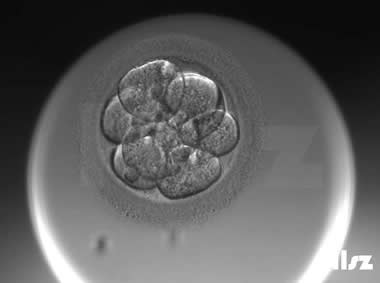 | |
| Ⅱa级:该枚D3胚胎为9细胞,碎片不超过10%,因此评级为Ⅱa级。 | |
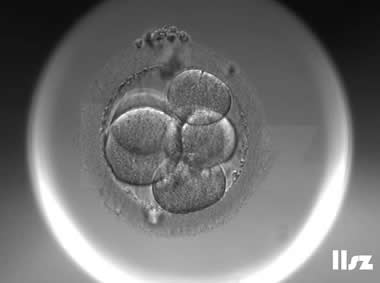 | |
| Ⅱa级:该枚D3胚胎为6细胞,碎片不超过10%,因此评级为Ⅱa级。 | |
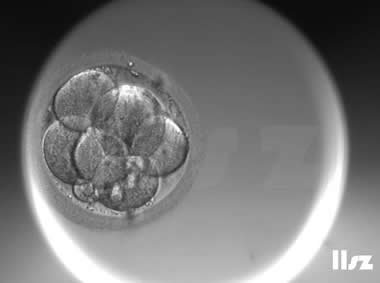 | |
| Ⅱa级:该枚D3胚胎为7细胞,碎片不超过10%,因此评级为Ⅱa级。 | |
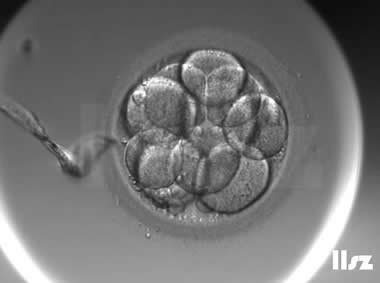 | |
| Ⅱb级:该枚D3胚胎为10细胞,碎片10%左右,因此评级为Ⅱa或Ⅱb级均可。 | |
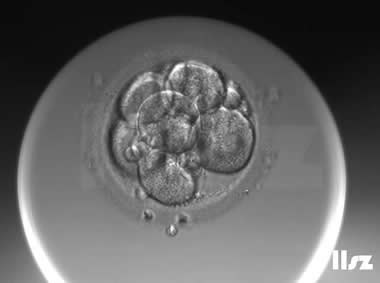 | |
| Ⅱb级:该枚D3胚胎为7细胞,但碎片超过10%,因此评级为Ⅱb级。 | |
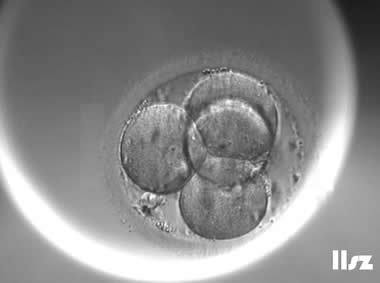 | |
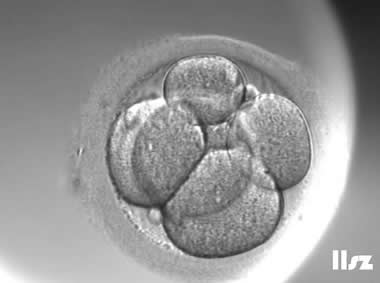
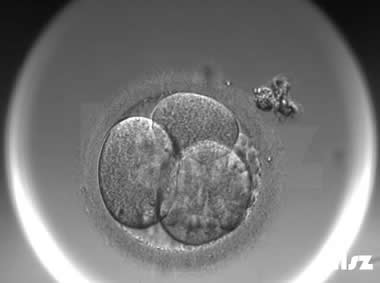
| Ⅲa级:该枚D3胚胎为4细胞,碎片不超过10%,因此评级为Ⅲa级。 | |
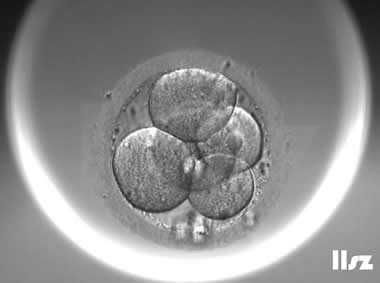 | |
| Ⅲa级:该枚D3胚胎为5细胞,碎片不超过10%,因此评级为Ⅲa级。 | |
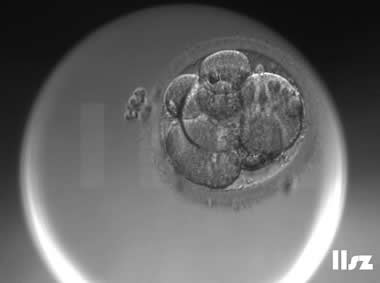 | |
| Ⅲb级:该枚D3胚胎为7细胞,碎片为10%左右,但由于不具备阶段特异性卵裂模式,因此评级为Ⅲb级。 | |
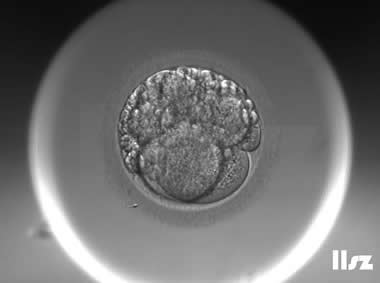 | |
| Ⅳ级:该枚D3胚胎仅2细胞,碎片超过50%,因此评级为Ⅳ级。 | |
4.6.2 胚胎的卵裂模式
卵裂期胚胎的形态学评估是目前卵裂胚评估的主要方式,然而,传统培养设备的局限性使得卵裂过程中卵裂模式的评估尚未得到充分重视。例如,同为3细胞卵裂胚,其来源可能是正常卵裂,也可能是直接卵裂、连续卵裂或逆向卵裂等异常模式。异常卵裂模式可能预示胚胎发育异常或增加流产风险。因此,深入研究和分类卵裂模式有助于更准确地评估胚胎质量,优化胚胎选择策略,为辅助生殖技术提供更有效的支持。
卵裂模式是指胚胎在卵裂过程中细胞分裂的规律性与同步性,分为正常卵裂和异常卵裂。异常卵裂模式包括直接卵裂、连续卵裂、逆向卵裂、不均等卵裂及卵裂球碎乱等。对每种模式的分裂过程及其对胚胎发育的影响进行详细研究,将为临床实践提供更科学的依据。
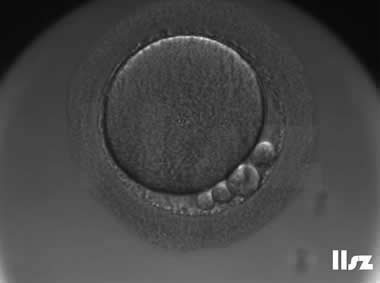
1. 正常卵裂模式
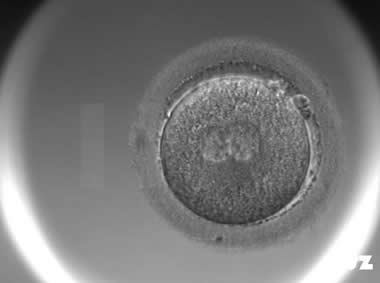 | |
正常2PN卵裂模式:受精卵第一次分裂:1细胞分裂为2细胞;第二次分裂:2细胞分裂为4细胞;第三次分裂:4细胞分裂为8细胞。 | |
2. 异常卵裂模式
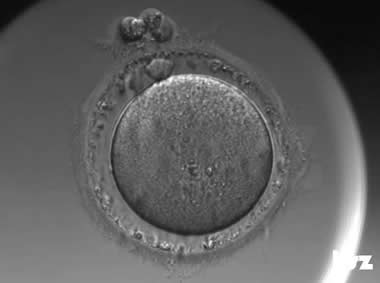
(1)直接卵裂(DC)
当一个卵裂球直接分裂为三个及以上多个子细胞,而没有经过正常的中间阶段时,被定义为直接卵裂。这种卵裂模式可能使DNA的分离不均等,导致染色体异常(如非整倍体)的发生。
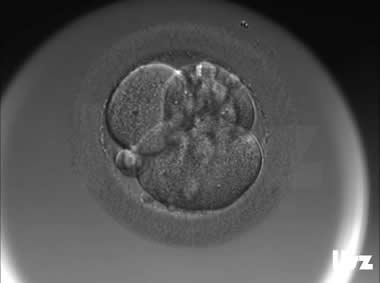 | |
直接卵裂:受精卵在第一次卵裂阶段发生了直接卵裂,1个细胞直接分裂为3个细胞。 | |
| |
直接卵裂:受精卵连续2次发生直接卵裂,第一次为1个细胞直接分裂为3个细胞;第二次为3细胞阶段中最大的1个细胞又分裂为3个细胞,最后,该胚胎发育成了囊胚。 | |
| |
直接卵裂:受精卵在第一次卵裂阶段发生了直接卵裂,1个细胞直接卵裂为4-5个细胞,最后,该胚胎发育成为了囊胚。 | |
| |
直接卵裂:受精卵在第二次卵裂阶段发生了直接卵裂,第一次卵裂中,1个细胞正常分裂为2个细胞;第二次卵裂中,2细胞中的1个细胞直接分裂为3个细胞。 | |
| |
直接卵裂:受精卵在第一次卵裂阶段发生了直接卵裂,1个细胞直接卵裂为3个细胞,该枚胚胎最后发育成了囊胚。 | |
(2)连续卵裂(DA)
连续卵裂是指卵裂球中的某个卵裂球的分裂明显比其它卵裂球要快,其中一个卵裂球分裂后,在其它卵裂球未分裂前再次发生分裂(即某个细胞连续发生了两次及以上的卵裂,但其它细胞还未发生卵裂)。这种异常的分裂过程可能导致发育不平衡,并影响胚胎的正常生长和发育。
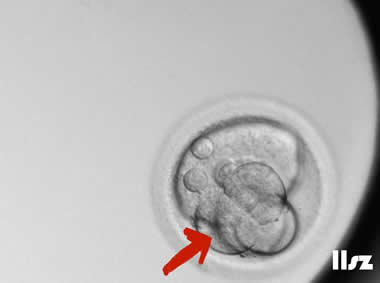 | |
连续卵裂:受精卵第一次卵裂后,在上面的细胞未发生卵裂的情况下,下面的细胞发生了多次卵裂,该胚胎最后发育成了4CC级的囊胚。 | |
| |
连续卵裂:在4细胞阶段,下方的细胞发生了2次连续卵裂后,上方的细胞才发生卵裂,该胚胎最后发育成为了可用囊胚。 | |
(3)逆向卵裂(RC)
逆向卵裂是指在卵裂过程中,原本分裂成两个卵裂球的细胞,后来又重新融合成一个卵裂球。与正常的卵裂模式不同,细胞在分裂后会合并,这可能导致发育缺陷并降低胚胎质量。
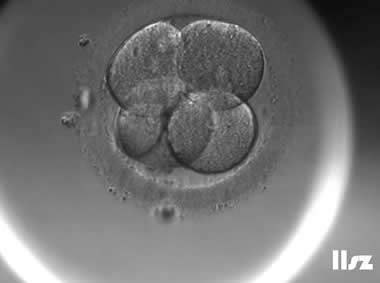 | |
逆向卵裂:在4细胞阶段,上方的2个细胞逆向卵裂,重新融合为1个细胞,4细胞变成了3细胞。 | |
| |
逆向卵裂:在第一次卵裂中,受精卵发生了直接卵裂,1个细胞分裂为4细胞。但是紧接着,其中两个细胞发生了逆向卵裂,重新融合为1个细胞,4细胞变成了3细胞,最后该胚胎发育成了囊胚。 | |
| |
逆向卵裂:在第二次卵裂中,有1个细胞细胞发生了直接卵裂,1个细胞分裂为3个细胞, 2个细胞直接变为了5细胞;随后发生了逆向卵裂,其中2个细胞重新融合为1个细胞,5细胞又变成了4细胞,最后该枚胚胎发育成了囊胚。 | |
(4)不均等卵裂(UB)
当卵裂后形成的细胞大小不均时,称为不均等卵裂。这样不均匀的分裂可能导致一个细胞较大,另一个细胞较小,从而影响重要细胞物质和基因的分配,进而可能导致发育问题,并影响胚胎质量。
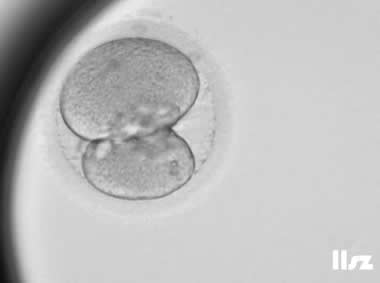 | |
不均等卵裂:在第一次卵裂的时候发生了不均等卵裂,受精卵分裂成了1大1小的两个细胞,最后该枚胚胎发育成了囊胚。 | |
(5)BF(卵裂球碎裂)
当卵裂球在分裂过程中破裂成不规则的碎片时,发生卵裂球碎裂。这通常不能形成正常的细胞,从而丧失发育能力。
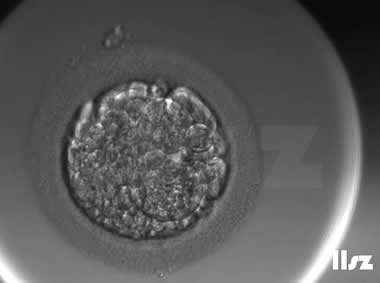 | |
| 卵裂球碎裂:受精卵在第一次卵裂阶段就直接碎裂为大小不一的碎片。 | |
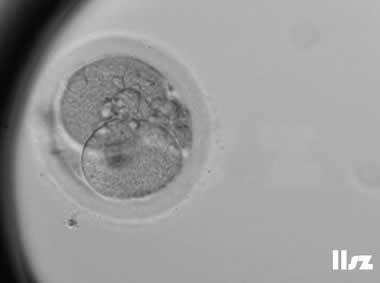 | |
| 卵裂球碎裂:受精卵第一次卵裂为2个细胞,但在2细胞阶段时,2个细胞均同时发生了碎裂。 | |